发布日期: 2020年06月03日
来源:生物通
文章内容
近年来,蛋白质泛素化成为基因表达调控研究的热点,泛素化在各类细胞信号通路中发挥重要的调节作用。泛素分子通常含有7种内部赖氨酸残基,通过这些残基可与其他泛素分子的甘氨酸C端相连产生分支,形成多聚泛素化修饰。
近年来又鉴定了一种新的多聚泛素链——线性泛素链,由两个泛素N、C端首尾相接而成。已有研究鉴定线性泛素化是由线性泛素化复合体(LUBAC)作为泛素连接酶特异性诱导,该复合体由血红素氧化IRP2泛素连接酶(HOIL-1L)、HOIL-1L互作蛋白(RNF31/HOIP)和SHANK相关域互作蛋白(SHARPIN)组成,同时去泛素化由线性连接特异的OTU去泛素化酶(OTULIN)介导。LUBAC/OTULIN广泛参与NF-kB、IFN、NLRP3、TRIM25等天然免疫相关蛋白的调控,但是具体的机制还未知。
线性泛素化修饰的生物学功能研究主要集中在NF-κB介导的免疫反应和细胞死亡等相关通路中,已经鉴定的线性泛素化修饰的底物仅有NEMO, IRF3, ASC和TRIM25几个。近期,苏州大学生物医学研究院郑慧教授团队在Nature Communications杂志上发表了题为“Regulation of the linear ubiquitination of STAT1 controls antiviral interferon signaling” 的研究论文,鉴定了线性泛素化修饰的一个新的底物,并首次揭示了蛋白线性泛素化修饰对干扰素(IFN)抗病毒信号的关键调控机制。

郑慧教授团队经过近几年的深入研究,发现信号转导与转录激活因子1(STAT1)在静息细胞中存在强烈的线性泛素化修饰,并通过一系列实验证实了STAT1是一个新的线性泛素化修饰的蛋白底物。
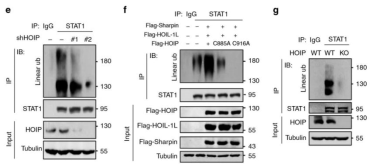
质谱分析显示了HOIP与STAT1的相关性,通过免疫沉淀、免疫荧光证实了两蛋白质间的相互作用,缺失实验进一步说明了作用位点在TAD结构域,而且该相互作用是组成性的,表明线性泛素化参与STAT1的表达调节。
研究人员在细胞中观察到内源性STAT1具有依赖于HOIP的强泛素化修饰,敲低HOIP将导致显著抑制内源和外源STAT1的线性泛素化。但是,HOIP的泛素E3连接酶失活突变体(C885A和C916A)失去了增强STAT1线性泛素化的能力,研究者进而构建了HOIP敲除细胞,发现细胞内STAT1完全无法线性泛素化。
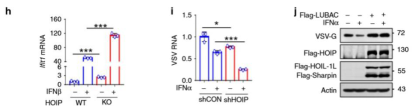
接着,研究人员试图探究线性泛素化的生物学意义,实验表明LUBAC/HOIP并没有影响STAT1的mRNA、蛋白质水平,LUBAC介导的STAT1活化抑制主要依赖于HOIP的E3连接酶活性。LUBAC过表达显著抑制了IFN-I诱导的STAT1激活,抑制ISG表达;敲除HOIP则促进IFN诱导ISRE启动子活性,进而增强IFN-α和IFN-β诱导ISG mRNA、蛋白表达,尤其是在RNA病毒、DNA病毒侵染时抗病毒活性显著增强。因此线性泛素化对STAT1介导的天然免疫起到限制作用。
研究人员推测抑制STAT1线性泛素化可能导致细胞STAT1的过度活化,即使在通过自分泌IFN进行信号传导时也是如此。为了解决这个假设,首先确定线性泛素化是否影响自分泌干扰素的产生,因为据报道线性泛素化的NEMO可以与TRAF3结合以抑制病毒刺激的IFN产生。研究人员过表达LUBAC对干扰素产生无明显影响,但是敲低HOIP在无外加干扰素的条件下也能激活内源STAT1,并上调ISG水平,显著增强抗病毒能力,在STAT1缺失的细胞中就无增强作用,因此线性泛素化调控的抗病毒效果依赖于STAT1。综合以上实验,可以认为线性泛素化起到维持IFN信号稳态的作用。
研究人员进而分析STAT1对IFN下游信号的具体调控机制,HOIP敲除或LUBAC过表达对于IFN下游其他蛋白质无影响,仅作用于STAT1通路。通过生物信息学分析结合质谱技术,鉴定出了STAT1的7个赖氨酸泛素化位点,通过氨基酸突变实验证实Lys511、Lys652为线性泛素化位点,能够抑制IFN抗病毒应答。
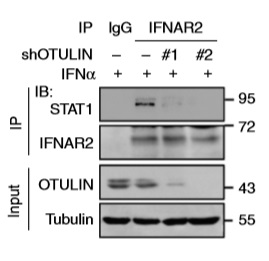
研究人员发现HOIP敲低影响胞质STAT1磷酸化水平,线性泛素化可能在STAT1入核调节STAT1的磷酸化。此外,LUBAC结合和随后的线性泛素化修饰不需要STAT1的Tyr701磷酸化。这些表明LUBAC可以在STAT1磷酸化之前诱导STAT1线性泛素化。结合以上对STAT1上游的IFN信号蛋白的分析,他们推测STAT1线性泛素化可以直接抑制JAK1诱导的STAT1激活。利用敲低、过表达、突变实验直接证明了推测,还证明了STAT1在Lys511和Lys652上的线性泛素化阻断了其与IFNAR2的相互作用。为了探究IFN如何激活STAT1,IFN诱导磷酸化的STAT1没有线性泛素化,因此研究人员推测IFN诱导能够除去STAT1线性泛素化。根据这种推测,IFNα和IFNβ处理均以时间依赖性方式诱导STAT1快速去线性泛素化。此外,OTULIN对IFN-I信号传导中STAT1线性泛素化的可能影响。过表达或敲除OTULIN显著影响了线性泛素化,外加IFN可增强OUTLIN与STAT1的结合,说明IFN激活STAT1由OTULIN介导。基于之前的结论,过表达或敲除实验也证明OTULIN增强STAT1与IFNAR2结合。
研究人员还探究了该机制在抗病毒中的作用。利用仙台病毒(SeV)、水疱性口炎病毒(VSV)侵染细胞,发现在感染较长时间后病毒诱导HOIP表达升高,并促进HOIP与STAT1结合,促进线性泛素化,负调节IFN信号通路。说明线性泛素化与磷酸化共同参与抗病毒应答。
线性泛素化调节IFN-I的抗病毒活性。研究人员进一步探讨了线性泛素化对宿主IFN-1信号传导和体内抗病毒活性的影响。HOIP或HOIL-1L的完全敲除具有致死性,因此,HOIL-1L杂合(Rbck1 +/-,赛业生物构建)小鼠已被广泛用作有效的线性泛素化缺陷模型。研究人员发现HOIL-1L杂合小鼠具有更强的IFN应答,STAT1高度活化,病毒显著减少。嵌合小鼠模型表明突变泛素化位点增强抗病毒反应。因此线性泛素化对调节天然免疫与抗病反应发挥重要作用。
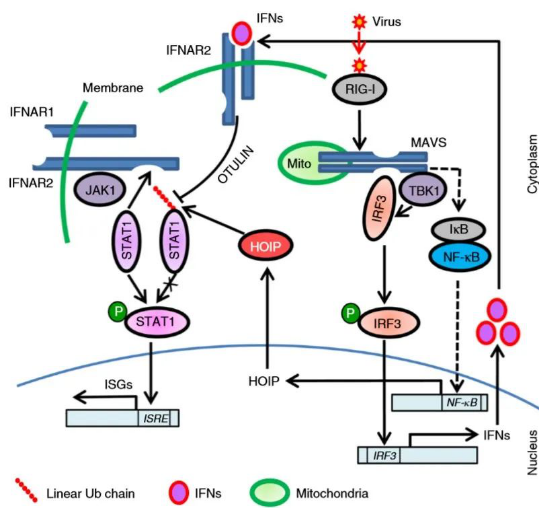
在该研究中,郑慧教授团队鉴定了STAT1作为蛋白质线性泛素化修饰的一个新的底物,揭示了线性泛素化修饰的另一个调控机制:线性泛素化修饰抑制转录因子与其上游信号的相互作用。该研究表明,STAT1线性泛素化修饰阻止了转录因子STAT1与IFN受体IFNAR2的结合,从而抑制了STAT1的磷酸化和活化,维持了细胞内IFN信号的稳态。这种对转录因子的内在负调控不同于NF-κB的抑制——转录因子NF-κB在细胞中存在一个内在负调控因子IκB蛋白,而STAT1并未发现这样一个内在负调控蛋白,为经典的干扰素途径提供了更加完整的框架,而且靶向LUBAC可能提高基于干扰素的抗病毒治疗效果。
作者简介:

郑慧博士,博导
苏州大学特聘教授
郑慧教授,2001年和2006年分别获得中南大学湘雅医学院医学学士学位和博士学位,2006-2007年留校做科研助理。2008-2013年在美国宾夕法尼亚大学从事干扰素受体的研究工作。2013年1月加入苏州大学生物医学研究院,任职特聘教授,同年入选江苏省“高层次海外引进创新创业”人才、江苏省杰出青年,2014年入选苏州市紧缺高层次人才,2016年入选江苏省六大人才高峰计划。迄今为止,已发表多篇高水平研究论文,包括PLoS Pathog,PNAS,Blood,Cell Rep,Mol Cell Biol,J Immunol,J Biol Chem等。其中一篇Blood论文被国际专家在同期Blood上发表专题评论。另一篇论文被多家国际科学媒体进行专题报道。
研究方向
我们的研究兴趣是宿主的广谱抗病毒机制。通过揭示宿主多样性的抗病毒信号,发掘宿主的抗病毒潜能,旨在发展出广谱抗病毒策略。目前,我们的研究焦点包括三个方面:1)如何增强先天抗病毒细胞因子Interferon (IFN)的抗病毒活性;2)鉴定具有广谱抗病毒或促病毒活性的宿主蛋白,并揭示其调控病毒感染的机制;3)发展潜在的抗病毒小分子抑制剂和干扰肽。
原文检索:
Regulation of the linear ubiquitination of STAT1 controls antiviral interferon signaling
DOI: 10.1038/s41467-020-14948-z
交流讨论